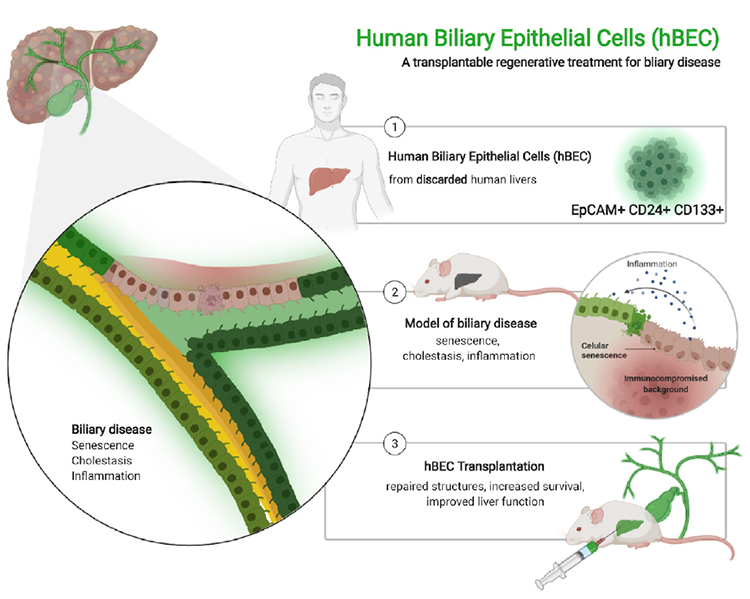
近日,来自英国爱丁堡大学的Stuart J. Forbes团队在Cell Stem Cell杂志在线发表了题为Human biliary epithelial cells from discarded donor livers rescue bile duct structure and function in a mouse model of biliary disease 的文章,为临床hBECs移植再生的应用带来新希望。研究人员从废弃的肝脏中分离并扩增了人胆道上皮细胞(human biliary epithelial cells, hBECs),将hBECs移植入胆道疾病小鼠模型后,hBECs可再生并修复受损的胆管,减少肝纤维化,降低死亡率。该研究为胆道疾病提供了一种全新的治疗方式。

原代hBECs主要从器官捐献者的肝脏中分离而来。这些肝脏最初都是计划用于肝移植的,但由于后期临床评估不过关(过度脂肪变性或纤维化)而被认为不适于移植。那么这些“不合适”的肝脏还有别的应用价值吗?为了鉴定和表征具有治疗潜力的hBECs,作者从肝脏组织中分离并分选了候选hBECs群。采用的分类策略是之前用于分离具有双潜能小鼠BEC的分选方法【2】,获得了两个候选hBECs群:CD45-/CD31-/EpCAM+/CD24+/CD133-(简称为CD133-)和CD45-/CD31-/EpCAM+/CD24+/CD133+(简称CD133+)。
随后,作者对从脂肪和健康肝脏中分离出的hBECs进行了全方面的表征:(1)RNA测序(RNA-seq)全转录组分析:与增殖相关的基因上调,与免疫系统过程调控相关的基因(如MUC1、MUC5B)、炎症反应相关的基因(如IL1LR1、GPX4、ADCY5)和细胞外基质组织相关的基因(LAMB3、MMP1)下调,提示 CD133+ hBECs的再生能力可能更强。(2)评估了CD133+ hBECs细胞再生潜力:脂肪变性肝脏来源的CD133+ hBECs中显著上调的基因包括那些与细胞增殖、代谢和细胞外基质组织相关的基因;与炎症反应和趋化因子介导的信号转导有关的基因显著下调,表明hBECs的再生潜力在脂肪变性条件下增加。(3)研究了CD133-和CD133+ hBECs的克隆形成能力:与CD133- hBECs相比,CD133+ hBECs的克隆形成效率显著提高,形成的克隆经过连续传代并存活超过15周,同时保留正常的二倍体核型。(4)CD133+ hBECs可以生长为类器官,并表达胆管细胞和祖细胞标记物(例如K19、SOX9、EpCAM、STEM121和LGR5);CD133+ hBECs也能够分化为肝细胞谱系,显示出独特的形态和转录特征,表明人和小鼠BECs之间具有相似的分化潜力。
接下来,作者将扩增后的hBECs移植到免疫受损的胆道疾病小鼠模型中以评估CD133+ hBECs群在体内的再生能力。基因敲除Mdm2(Krt19CreER Mdm2fl/fl Rag2-/- Il2rg-/-)+ DDC饮食(3,5-diethoxycarbonyl-1,4-dihydrocollidine, DDC)的小鼠表现出晚期胆道疾病的特征。在诱导产生衰老和胆道损伤后,作者在小鼠脾内注射了1×106个CD133+ hBECs(对照组注射PBS)。后续分析发现,与对照组小鼠相比较,移植CD133+ hBECs的小鼠在多个方面得到了改善:小鼠肝脏内病变减少,肝脾肿大程度减轻;胆红素水平降低;生存率显著升高,纤维化程度明显降低。随后作者还在缺血再灌注损伤(ischemia reperfusion injury, IRI)小鼠模型中评估了hBECs的再生能力。与预期结果一致,hBECs也可以明显改善IRI小鼠的疾病表型。
进一步,作者探究了hBEC移植改善疾病表型的生物学机制。hBEC移植后,肝内胆道的解剖学结构得以恢复,多型核浸润核实质损伤也减少。移植的对照hMSCs(human mesenchymal stem cells, 间充质干细胞)以不规则的随机模式种植在小鼠实质中,表现为弥漫性浸润;相反,hBECs仅在小鼠胆道附近植入,其他组织中(例如脾脏或肺)没有hBECs,表明移植后,hBECs会进行靶向迁移。对hBEC移植后肝脏的组织学反应进行表征:与PBS对照组相比,hBEC移植肝脏中,K19+细胞水平增加,aSMA水平降低(表明星状细胞激活减少),CD45+细胞数量增加,HMGB1(high-mobility group box 1)从肝细胞的细胞质转移到细胞核,表明 hBEC 移植时存在抗炎机制。更有意思的是,hBEC移植后,K19+胆管细胞表达HNF4a,表明双潜能促再生机制的激活。作者还进行了磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP),以探究细胞移植对肝外胆道系统的影响。结果显示,PBS治疗组小鼠出现胆囊管闭塞、狭窄、胆囊和CBD扩张,相反,hBEC移植小鼠的CBD和胆囊直径明显减小,而胆囊管增加,表明移植可改善胆道肝外区域的狭窄。
最后,作者还开发了一种符合当前GMP规定的分离和培养工艺。该流程使用自动化步骤和符合GMP的试剂进行肝脏分离,然后进行临床级磁珠分类。在符合GMP的条件下分离细胞,并对每克新鲜人肝脏中CD133+ hBECs总数进行量化。与标准研究方案相比,CD133+ hBECs总数显著增加,从平均每克肝脏260.33 个hBECs增加到6015.33个hBECs,细胞碎片也明显减少。同时,作者发现,肝脏的保存方法(如非原位低温氧合机灌注)不会影响分离出的CD133-和CD133+ hBECs的总数。对GMP条件下分离出的CD133+ hBECs的克隆形成能力和扩增能力进行评估:hBECs在一段时间内保持其表型,hBEC纯度在第一个培养阶段后显著增加,并在后续的传代中始终保持较高的水平。值得注意的是,废弃的肝脏切片可进行冷冻,长期保存后也可有效分离hBECs,其克隆形成效率相似;扩增的hBECs也可以在液氮中无限期储存,解冻后再次用于培养。最后,CD133+ hBECs可以在2D或3D的符合GMP的支架中进行体外培养和扩增,在增殖和表达hBECs相关标志物的同时保持细胞活力。这些结果表明,肝脏切片和hBEC培养物都可以在GMP条件下分离、扩大和储存,并可作为hBECs的来源,在需要时可用于临床。
总的来说,研究人员鉴定了一个人肝脏BECs亚群,可以从受损的器官中分离出来,并在严格的GMP-compatible条件下长期培养而不产生表型漂移。hBECs移植后,细胞迁移到胆道附近,可以显著改善动物的生存、纤维化、炎症和生化肝功能。这种移植介导原生细胞的促再生作用,促进肝脏损伤的修复。该研究介绍的是一种潜在的人类治疗胆道疾病的实验方法,这一细胞疗法成功地治疗了患有胆道疾病的动物,为使用这些细胞作为胆道疾病的再生疗法提供了临床试验机会。作者认为,使该程序适应临床实践还需要确定最佳的注射途径,虽然肝动脉、门静脉和胆道系统都是细胞移植的可能途径,但在肝脏受损的情况下,每一种途径都有独特的挑战需要克服。
原文链接:
https://doi.org/10.1016/j.stem.2022.02.006













